亲爱的读者朋友们,大家好。
今天给大家介绍一篇发表于Alzheimer's & dementia : the journal of the Alzheimer's Association(中科院一区,IF: 11.1)的研究论文,“Cumulative and variable depression symptom exposure and incident dementia: Panel data analysis of four longitudinal cohort studies",该研究基于CHARLS+ELSA+HRS+SHARE数据库,调查了中老年人累积和变化的抑郁症状暴露与痴呆发病率之间的关联。

亮点一:还是选题这篇文章关注“抑郁症状变化”,调查了其与中老年人痴呆发病之间的关联。
痴呆是一种进行性神经退行性综合征,其特征是潜伏的认知能力下降和日常生活活动受损。它极大地导致老年人的残疾和死亡率,对患者和家人的生活质量产生不利影响,并带来相当大的医疗保健和社会护理费用。抑郁症,尤其是晚发性抑郁症,已被确定为痴呆的一个重要的、可改变的风险因素。柳叶刀痴呆委员会认识到抑郁症和痴呆之间潜在的双向关系,表明抑郁症既可能是潜在神经变性的前驱表现,也可能是痴呆发病的独立风险因素。
在鹿特丹的研究中,研究人员观察到,在基线时有临床显著抑郁症状的参与者,在5-10年的随访中,阿尔茨海默病和其他痴呆症的发病率明显更高。阿尔茨海默病遗传流行病学(MIRAGE)研究中的多机构研究进一步支持,该研究发现早发性和晚发性抑郁发作都与更快地进展为临床痴呆相关,这表明情绪障碍可能揭示潜在的神经病理学或直接导致神经元损伤。大量证据表明,抑郁症或抑郁症状加重与认知能力下降加速和痴呆风险增加有关。研究表明,慢性炎症、血管变化、下丘脑-垂体-肾上腺(HPA)轴失调以及神经营养因子和神经递质系统的改变有助于抑郁症和痴呆之间的复杂机制。
近年来,大多数关于抑郁症对痴呆影响的证据都依赖于单时间点测量,这可能无法捕捉痴呆的持续生理脆弱性。众所周知,抑郁症的病程是可变的;因此,单点测量不足以捕捉抑郁症状随时间的个体波动。捕捉抑郁发作的强度和持续时间,并结合随时间的累积暴露量,可以增强对抑郁和痴呆发病风险之间关系的理解。
因此,基于四个基于人群的大型队列,即英国老龄化纵向研究(ELSA)、健康和退休研究(HRS)、欧洲健康、老龄化和退休调查(SHARE)以及中国健康和退休纵向研究(CHARLS),我们旨在量化(1)抑郁症状的高变异性,(2)长期累积抑郁症状,(3)高抑郁症状的暴露持续时间,以及(4)抑郁症状的累积负担与痴呆发病风险之间的关联。我们进一步评估了这些关联是否受到抑郁症状积累的时间模式的影响。
亮点二:研究方法严谨科学1. 数据来源和研究人群
数据收集自四个国际老龄化队列:ELSA、HRS、SHARE和CHARLS。具体来说,我们分析了2010年至2020年的数据,涵盖了ELSA的第6-8波(2012-2016年)、HRS的第10-12波(2010-2014年)、SHARE的第6-8波(2016-2020年)和CHARLS的第1-3波(2011-2015年)。
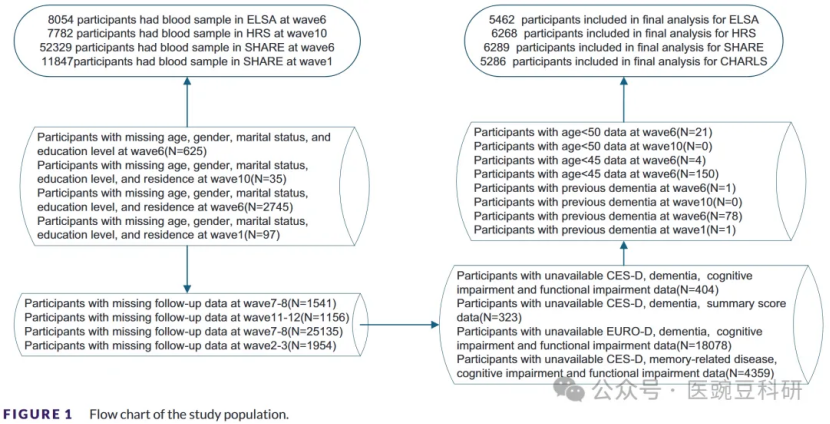
该研究包括来自四个基于人群的队列的基线血样的参与者:ELSA(第6波,N=8054)、HRS(第10波,N=7782)、SHARE(第6波,N=52, 329)和CHARLS(第1波,N=11, 847)。在每个队列中,我们依次排除了以下参与者:(1)缺失社会人口学信息;(2)年龄低于队列特异性阈值(ELSA和HRS<50岁;SHARE和CHARLS<45岁);(3)基线时的普遍痴呆;(4)后续两波失访;或(5)不完整的抑郁量表(CES-D)和欧洲抑郁量表(EURO-D)认知或功能评估。该过程产生了ELSA中5462名参与者、HRS中6268名参与者、SHARE中6289名参与者和CHARLS中5286名参与者的最终分析样本。研究程序如图1所示。所有队列都获得了各自机构审查委员会的伦理批准,并在入组前获得了参与者的书面知情同意。
2. 抑郁症状和访视间变异性的评估
在ELSA和HRS中,抑郁症状使用CES-D-8进行评估,CHARLS使用CES-D-10,SHARE使用EURO-D量表。两个CES-D-8版本的原始评分范围为0-8,CES-D-10为0-30,EURO-D为0-12。我们将抑郁症状定义为达到或超过特定阈值的评分(HRS和ELSA≥3,CHARLS≥10,SHARE≥4)。
此外,我们通过计算标准差(SD)、变异系数(CV)和独立于平均值的变异(VIM)来量化研究访视中抑郁症状的访视间变异性(VVV),以评估症状稳定性并评估VVV与痴呆发病风险之间的关联。我们将VIM计算为100 × SD/mean,其中β是ln(SD)对ln(mean)的线性回归的回归系数,并将CV计算为SD与各次访视的平均CES-D/EURO-D评分的比率。
3. 累积性抑郁症状及其时程累积抑郁症状(CumDS)定义为每对连续访视的CES-D/EURO-D的总和平均值,将该平均值乘以这些访视之间的年间隔,并在所有间隔中求和。我们通过将CumDS除以总随访时间得出累积平均抑郁症状评分(CumADS)。高抑郁症状暴露持续时间定义为两次访视中CES-D/EURO-D评分高(超过通过以结果为导向的方法计算的临界值,以最大化对数秩统计)的访视次数,量化为0、2和4年。为了表征症状累积轨迹,我们在所有三个波中拟合了CES-D/EURO-D评分与时间(自首次就诊以来的年数)的线性回归;得到的斜率表明抑郁症状是随着时间的推移而增加还是减少。抑郁症状在三个时间点的变化模式分为减少-减少、减少-增加、增加-减少或增加-增加。4. 痴呆的评估这些队列进行了认知测试,包括记忆、时间定向和执行功能测试。四个队列的记忆评估是一致的,而时间定向和执行功能测量是不同的。
·通过对ELSA、HRS、SHARE和CHARLS中10个不相关单词的即时和延迟回忆来评估记忆。总记忆得分为20分,是即时和延迟单词回忆得分的总和,每个单词1分。
·对于ELSA、SHARE和CHARLS中的时间定向,参与者被要求回忆星期、月份和年份,根据每个正确回忆的项目1分得出定向分数(0-4)。
·对于执行功能,CHARLS进行了连续七次减法测试(0-5),而ELSA和SHARE使用了动物命名流畅性。HRS通过向后计数和连续七次减法测试评估执行功能,综合评分范围为0-7。
痴呆症的定义要么是自我报告的医生诊断,要么是通过结合认知和功能评估的经过验证的算法标准来定义的。痴呆症的发生是通过以下问题来评估的:“医生是否告诉过你你患有痴呆症、衰老或任何其他严重的记忆障碍?”对于ELSA和HRS;医生是否告诉过您患有阿尔茨海默病、痴呆症或其他严重的记忆障碍?“对于SHARE。在HRS中,痴呆由认知汇总评分(0-27)定义,评分≤6表示痴呆;该汇总评分涵盖了记忆和执行功能领域。在ELSA、SHARE和CHARLS中,痴呆被定义为认知障碍和功能依赖的同时发生。认知障碍被定义为在任何认知领域得分低于教育分层人群平均值≥1.5 SD。功能障碍被定义为自我报告的至少一项日常生活活动困难,包括洗澡、吃饭、穿衣、转移或在房间里走动。因为确定结合了算法阈值和自我/代理报告而不是临床裁决,所以我们将结果称为“可能的痴呆/probable dementia”(“痴呆”在下文中表示可能的痴呆)。5. 协变量本研究收集了以下协变量。(I)人口统计数据:年龄、性别(“男性”、“女性”)、婚姻状况(“已婚”、“其他”)、教育程度(“大专以上”、“高中”、“高中以下”)、居住地(“农村”、“城市”);(II)生活方式信息:吸烟状况(“当前吸烟者”、“以前吸烟者”、“从不吸烟”);饮酒状况;(III)体格检查:收缩压(SBP)、舒张压(DBP)、体重指数(BMI);和(IV)既往病史:抑郁症、高血压、糖尿病、心脏病、中风;㈤实验室检查:C反应蛋白(CRP)、糖化血红蛋白(HbA1c)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)。所有合并症均根据参与者提供的自我报告病史进行定义。6. 统计分析我们采用描述性统计来总结研究参与者的基线特征。正态分布的连续变量表示为平均值±SD,非正态分布的连续变量表示为中位数(四分位数间距[IQR])。分类变量以计数(N)和百分比(%)表示。采用单变量和多变量Cox比例风险回归模型研究抑郁症状与痴呆发病率的关系,用风险比(HR)和95%置信区间(95%CI)表示,并对模型中的相关变量进行调整。估计了四个模型:模型1没有调整变量;模型2根据年龄、性别、婚姻状况、教育水平和居住地进行了调整;模型3针对模型2中的变量和吸烟状况、饮酒状况、CRP、HbA1c、TC和HDL-C进行了调整;模型4针对模型3和高血压、糖尿病、心脏病和中风中的变量进行了调整。CumDS和CumADS作为连续变量和基于四分位数的分类变量包含在每个模型中。类似地,累积负荷、暴露持续时间、斜率和时程模式也被纳入其中。使用每个四分位数中的中位CumDS、CumADS和暴露持续时间计算趋势的p值。我们基于四个调整后的Cox回归模型建立了限制性立方样条(RCS)模型,遵循模型选择的贝叶斯信息标准,以探索CumADS与痴呆发病率的潜在非线性关联。对于每个参与者,我们使用每个波记录的年龄来计算随访时间。对于具有三个波的队列,CumDS和CumADS计算为配对访视平均值的时间加权和;Cox模型的随访时间为事件/删失年龄减去基线年龄(延迟入组使用基线年龄)。多重插补通过模板方法(R包“VIM”)和多重插值方法(R包“mice”)实现。此外,还进行了亚组分析,以研究CumADS和痴呆之间的关系是否根据协变量的状态(年龄、性别、婚姻状况、教育水平、吸烟状况、饮酒状况、高血压、糖尿病、心脏病、中风)而变化。为了帮助解释在某些队列特异性四分位数比较中观察到的极端相对危害,我们生成了按队列特异性累积抑郁症状四分位数分层的KaplanMeier(KM)生存曲线。使用survfit函数(R包“生存”)估计KM曲线,并使用对数秩检验在四分位数之间进行比较。当极端相对估计值可能反映暴露分布中的稀疏事件时,这些描述性KM分析通过呈现绝对事件概率和促进解释来补充Cox模型HR估计值。为了减少前驱期痴呆反向因果关系的可能性,我们进行了补充滞后分析。具体来说,我们排除了在第二个研究波(即,在第一个波间间隔内,队列中≈2年)新分类为痴呆的参与者,重新估计了剩余风险样本中的主要Cox比例风险模型,并将滞后分析的结果与主要估计进行了比较,以评估早期事件病例的影响以及我们的发现对潜在前驱效应的稳健性。最后,在每个队列中,我们进行了完全病例逻辑回归敏感性分析,以评估我们发现的稳健性。为了解决抑郁工具和评分范围的差异,我们使用每个队列中的z标准化抑郁症状评分进行了敏感性分析(每个评分以均值为中心,除以队列标准差;z=(x均值)/SD)。所有统计分析均在R(版本4.4.2)中进行。双侧p值<0.05被认为具有统计学意义。亮点三:清晰呈现研究结果1. 参与者特征表1总结了四个队列中23,305名参与者的基线特征:ELSA为5462名,HRS为6268名,SHARE为6289名,CHARLS为5286名。ELSA的中位基线年龄为65.0岁(IQR 60.072.0),HRS为63.0岁(IQR 56.0-73.0),SHARE为68.0岁(IQR 63.0-75.0),CHARLS为57.0岁(IQR 50.0-63.0)。不同队列的教育程度存在显著差异:47.0%的ELSA、41.0%的HRS、30.0%的SHARE和4.3%的CHARLS报告了大学或更高的教育程度。健康行为和居住模式因队列而异。ELSA目前的吸烟率为11.0%,HRS为15.0%,SHARE为49.0%,CHARLS为33.0%;ELSA的酒精使用患病率从22.0%到89.0%不等。HRS的中位BMI最高(29.0 kg/m2,IQR 26.0-34.0),CHARLS的中位BMI最低(23.5 kg/m2,IQR 21.2-26.1)。心血管和代谢共病特征也不同:高血压患病率从CHARLS的27.0%到HRS的56.0%不等;ELSA的糖尿病患病率为9.7%,HRS为21.0%,SHARE为15.0%,CHARLS为6.7%。各队列的心脏病患病率范围为17.0%至19.0%,而卒中史范围为2.1%至5.8%。由队列特异性CES-D或EURO-D阈值定义的抑郁症升高的患病率在ELSA为18.0%,在HRS为21.0%,在SHARE为23.0%,在CHARLS为32.0%。CHARLS的中位CRP范围为1.03 mg/L(IQR 0.55-2.10)至SHARE的2.04 mg/L(IQR 1.47-3.09)。ELSA的中位TC为5.20 mmol/L(IQR 3.70-6.10),SHARE为224 mg/dL(IQR 208-240);HDL-C的中位数范围为CHARLS的49 mg/dL(IQR 40-59)至SHARE的69 mg/dL(IQR 63-75)。ELSA的中位HbA1c为38 mmol/mol(IQR 32-41),份额为5.96%(IQR 5.71-6.25)。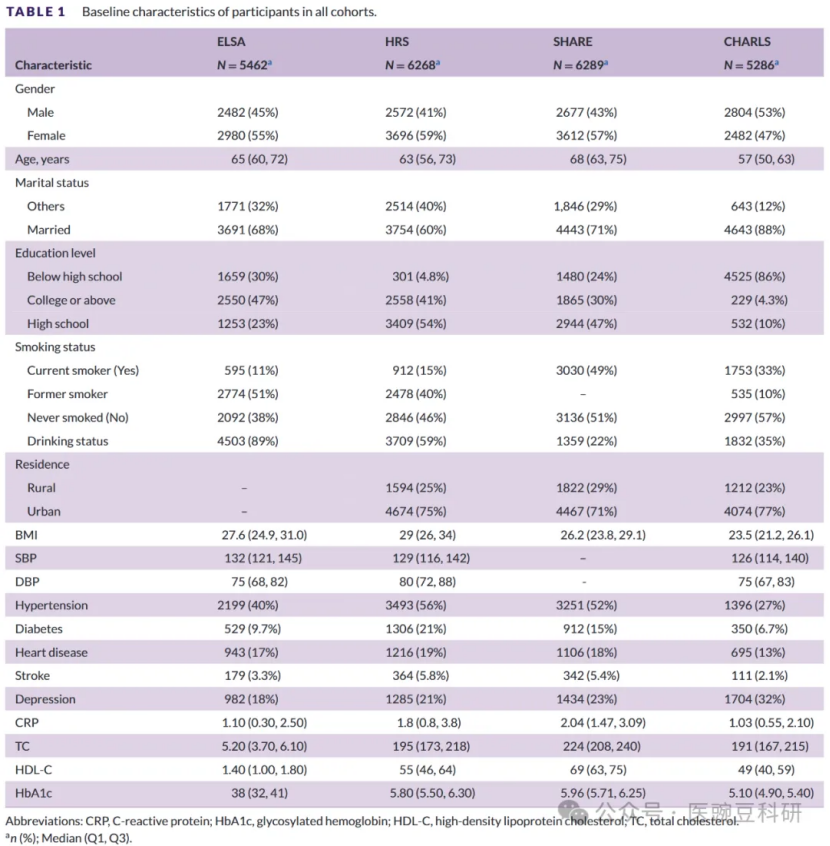
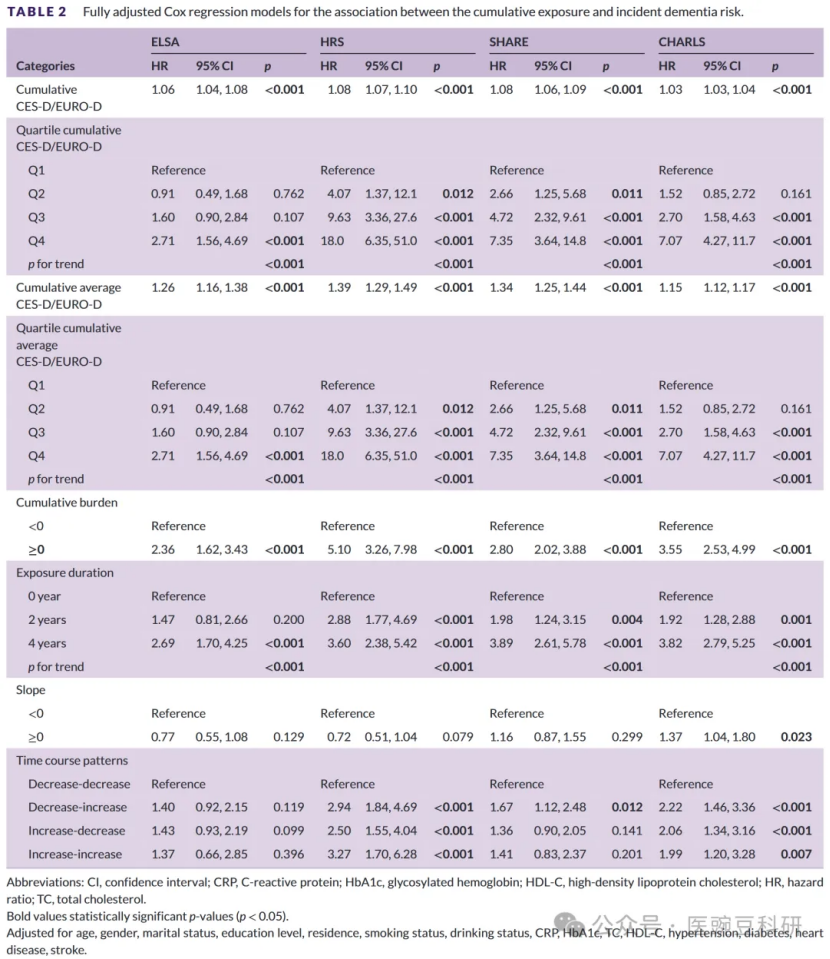
2. 累积暴露与痴呆发病的关系在完全校正的Cox模型中(模型4;表2),在所有四个队列中,较高的累积抑郁症状暴露与较高的痴呆发病率呈剂量依赖性强相关(所有p趋势<0.001)。具体而言,累积评分每增加1分,风险增加3%至8%(ELSA 1.06,95%CI 1.04-1.08;HRS 1.08,1.07-1.10;SHARE 1.08,1.06-1.09;CHARLS 1.03,1.03-1.04)。与最低四分位数相比,最高四分位数的参与者表现出2.7倍(ELSA;HR 2.71,1.56-4.69)至18.0倍(HRS;HR 18.0,6.35-51.0)的更大风险(所有p趋势<0.001)。具有任何阳性累积负担(≥0)的患者面临2.4至5.1倍的风险升高(ELSA HR 2.36,HRS HR 5.10,SHARE HR 2.80,CHARLS HR 3.55;所有p<0.001)。持续高症状暴露4年与无症状暴露相比,风险高2.7至3.9倍(ELSA HR 2.69,HRS HR 3.60,SHARE HR 3.89,CHARLS HR 3.82;所有p趋势<0.001)。轨迹分析显示,恶化模式,特别是“增加-增加”(小时数高达3.27小时)和“减少-增加”(小时数高达2.94小时;1.67份额),与最大的危害相关,而症状进展的斜率仅在CHARLS中达到显著性(HR 1.3795%CI 1.04-1.80;p=0.023)。这些发现在模型1-3中持续存在,强调了抑郁症状的程度和持久性独立地增加了痴呆风险(表S1-S4)。
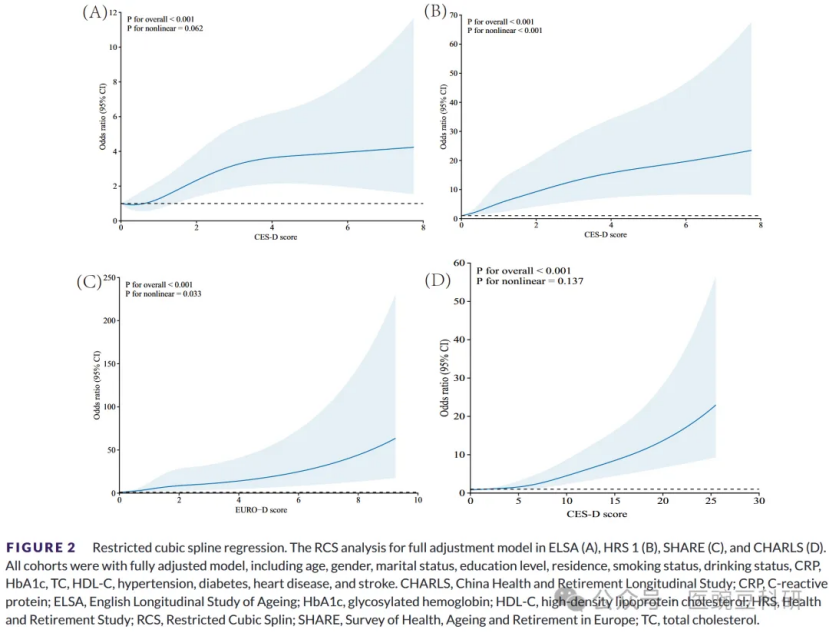
按累积抑郁症状四分位数分层的KM曲线如图S1-S4所示。这些基于KM的绝对估计表明,随着时间的推移,最高累积抑郁四分位数、时程模式和暴露持续时间的参与者经历了更高的绝对痴呆发病率,并有助于将大的相对危害(例如,HR≈18,以小时为单位)置于背景中,这主要反映了极端暴露阶层中极少数参与者/事件。考虑死亡的竞争性风险分析结果在方向上是一致的。在所有四个队列中,CumADS的RCS建模显示,在完全调整的模型中,与痴呆事件存在一致的强、正的剂量反应相关性。在ELSA和CHARLS(图2A,D)中,样条曲线以接近线性的方式上升(p-overall<0.001;p-非线性分别为0.062和0.137),表明CumADS中的每一个额外点都会稳步增加痴呆风险,而没有安全阈值的证据。相比之下,HRS表现出明显的J形模式(p-overall<0.001;p-非线性<0.001),痴呆几率在急剧上升之前在低CumADS评分下保持平稳(图2B)。SHARE的EURO-D样条处于中间位置:风险几乎线性增加,直到CumADS大约等于6(图2C),然后在更高的分数下加速得更快(p-overall<0.001;p-非线性=0.033)。在所有数据集中,即使CumADS的适度升高也与痴呆风险增加相关,这强调了识别和减轻整个暴露范围内抑郁症状的公共卫生必要性。
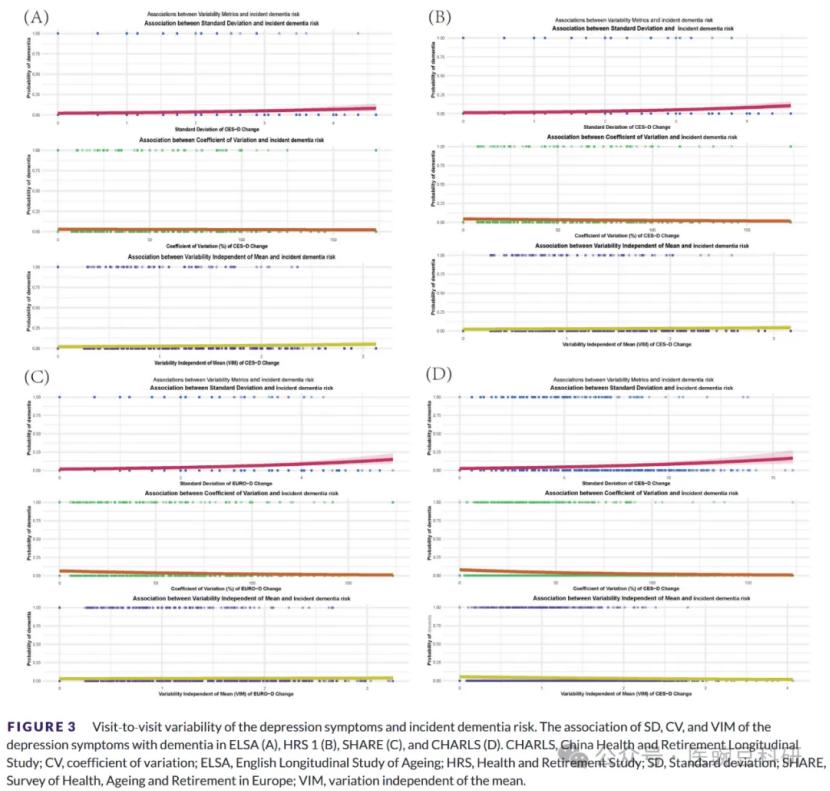
3. 抑郁症状的VVV与痴呆发病的关系
在四个纵向队列(ELSA、HRS、SHARE和CHARLS)中,通过访视特异性SD、CV和VIM量化的抑郁症状的参与者内变异性在个体之间存在显著差异。一些参与者表现出围绕其个人平均值的分数紧密聚类(低SD和CV),而另一些参与者表现出明显的分散(高SD和CV)。每个队列的散点图分析显示了正的线性趋势:较高的SD值对应于预测的痴呆风险的增量增加,CV的模式类似。这些发现表明,随着时间的推移,抑郁症状中更大的绝对SD和相对CV波动与痴呆风险升高适度但一致地相关。在采用VIM的敏感性分析中,VIM和痴呆之间的关联反映了SD和CV观察到的关联。因此,VIM分析加强了SD和CV的发现,提供了强有力的证据表明抑郁症状轨迹的可变性与痴呆风险增加相关(图3A-D)。总的来说,这些结果强调了评估抑郁症状作为痴呆独立预测因子的访视间变异性的重要性。
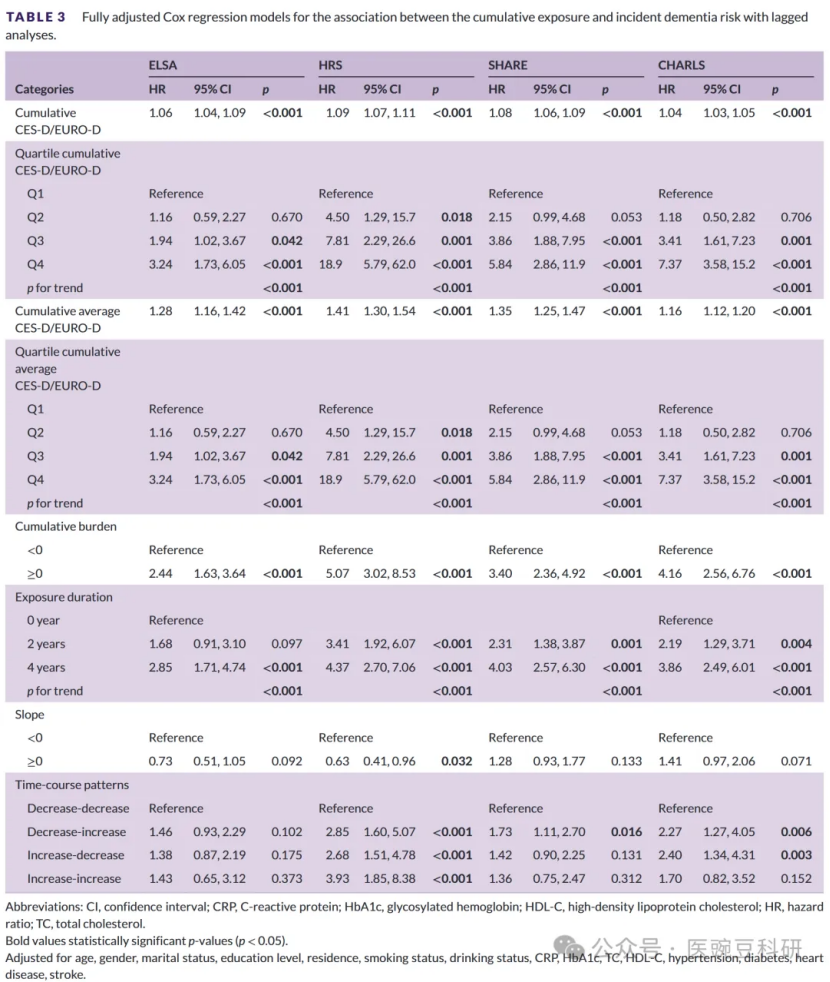
4. 滞后分析为了降低前驱期痴呆解释我们发现的可能性,我们在排除了第二波研究中新分类为痴呆的参与者后,重新运行了完全调整的Cox模型(表3)。保留了主要关联(表S5-S8)。累积抑郁症状的单位相关性仍然显著,并且与主要分析的幅度相似:ELSA HR 1.06(95%CI 1.04-1.09),HRS HR 1.09(95%CI 1.071.11),SHARE HR 1.08(95%CI 1.06-1.09)和CHARLS HR 1.04(95%CI 1.03-1.05)(所有p<0.001)。在滞后样本中,极端负荷(Q4与Q1)的比较仍然较高(ELSA HR 3.24【1.73-6.05】;HRS HR 18.9【5.79-62.0】;SHARE HR 5.84【2.8611.9】;CHARLS HR 7.37【3.58-15.2】;所有p<0.001),累积负担(≥0 vs<0)继续在队列中赋予显著更高的风险(ELSA 2.44【1.63-3.64】;HRS 5.07【3.02-8.53】;SHARE 3.40【2.36-4.92】;CHARLS 4.16【2.56-6.76】;所有p<0.001)。持续的高症状暴露(4年对0年)再次显示出稳健的风险增加(ELSA 2.85【1.71-4.74】;HRS 4.37【2.70-7.06】;份额4.03【2.57-6.30】;CHARLS 3.86【2.49-6.01】;所有p<0.001)。轨迹分析产生了可比的结果:涉及症状增加的模式(例如,HRS增加-增加HR 3.93【1.85-8.38】;HR下降-增加2.85【1.60-5.07】)仍然与痴呆密切相关。值得注意的是,症状进展斜率的估计值变化不大:HRS中先前不显著的斜率在滞后分析中变得具有统计学意义(斜率≥0:HR 0.63,95%CI 0.41-0.96,p=0.032),而其他队列中的斜率效应没有变化或处于临界水平。总体而言,排除早期事件病例并没有实质性减弱相关性,表明我们的主要发现不太可能仅仅是由前驱抑郁症驱动的。
5. 亚组分析和敏感性分析我们在每个队列中进行了亚组分析,以评估CumADS和痴呆发病率之间的关联是否因关键人口统计学和临床因素而异(图4A-D)。在按年龄(45-60/65 vs≥60/65岁)、性别、婚姻状况、教育水平、吸烟状况、饮酒、高血压、糖尿病、心脏病和卒中史定义的各阶层中,CumADS每增加1 SD的痴呆HRs持续升高,并且没有一个相互作用检验具有统计学意义(所有相互作用的p>0.05)。这些发现表明,累积抑郁症状和痴呆风险之间的剂量反应关系在不同的人群亚组中是稳健和一致的。
使用完整病例逻辑回归模型的敏感性分析证实了主要Cox结果(表S9-S12)。在四个队列中,CumDS和CumADS每增加1个单位仍与痴呆发病率显著相关:ELSA每增加1个单位的比值比(ORs)为1.07(95%CI 1.04-1.09),HRS为1.09(95%CI 1.07-1.12),SHARE为1.09(95%CI 1.07-1.11),CHARLS为1.04(95%CI 1.03-1.04)(所有p<0.001)。四分位数分析显示单调的剂量反应梯度;例如,比较最高与最低四分位数的完全调整ORs范围为2.95(ELSA)至20.2(小时)。累积负荷(≥0 vs<0)与2.62(ELSA)至5.43(HRS)的ORs相关,暴露持续时间(≥4 vs 0年)产生的ORs在3.02(ELSA)至3.65(HRS)之间。在所有队列中,以症状持续或增加为特征的时程模式与痴呆风险升高一致。总体而言,这些敏感性估计值在幅度和方向上都与主要Cox结果一致,证实了观察到的关联的稳健性。为了解决不同队列中抑郁工具和评分范围的差异,我们使用队列特异性z标准化累积抑郁症状指标(每增加1个SD)重复了完全调整的Cox模型。相关性的方向和显著性持续存在:CumADS每增加1 SD,合并HR为1.18(95%CI 1.161.19)。基于z标准化评分的队列特异性对比与主要分析基本一致(Q4 vs Q1:ELSA HR 2.58,HRS HR 18.1,SHARE HR 7.57,CHARLS HR 6.12;累积负荷≥0 vs<0:ELSA HR 2.33,HRS HR 3.18,SHARE HR 2.87,CHARLS HR 3.34)。暴露-持续时间效应(4年对0年)同样保持稳健(跨队列的z标准化HRs为3.08-3.94)。这些结果表明,我们的发现不是由抑郁工具或量表范围的差异驱动的,并且观察到的关联对于标准化的协调是稳健的(表S13-S16)。医豌豆锐评 这篇文章给我们的启发,不仅仅是选题层面的,还有数据分析、统计学层面的。
选题:①研究聚焦于“抑郁症状的长期累积和波动”对痴呆症发病风险的影响,这是目前较少深入探索的方向。②过去大多数研究仅采用一次性抑郁测量,该研究通过多次测量评估抑郁症状的累积负荷、持续时间、变化趋势和波动性,全方位反映心理健康对认知退化的潜在影响。③强调抑郁作为一个“可干预、可监测”的痴呆风险因素,具有很强的公共卫生意义和干预价值。 统计学:①使用多种统计方法,包括多变量Cox回归、限制立方样条(RCS)、分层分析、敏感性分析、滞后分析等,确保结果稳健。②抑郁症状暴露被细分为多个维度:累积评分(CumDS/CumADS)、高症状持续时间、症状波动程度(SD、CV、VIM)、时间趋势等,分析全面细致。③使用四个模型逐步调整混杂因素,包含人口学特征、生活方式、代谢指标、基础疾病等,控制混杂干扰。④进行了滞后分析和多种敏感性检验(包括标准化评分分析),加强了因果推断的可靠性。 启发:①发现抑郁症状的“累积负担”与痴呆发生呈显著正相关,呈现强烈的剂量反应关系,风险最高可达18倍。②不仅累积程度重要,症状的“波动性”同样是独立的风险因素,提示情绪稳定性对认知健康也有重要影响。③抑郁症状“持续恶化”的人群(如“持续上升”的变化轨迹)痴呆风险最高,强调了监测抑郁变化趋势的必要性。④四个队列(英、美、欧、中)分析结果一致,说明这一发现具有跨文化、跨人群的普遍性。⑤支持将“情绪监测”纳入中老年人痴呆预防策略,尤其是识别长期抑郁负担较重和症状波动大的人群。 数据库:①数据来自四个国际权威队列:英国ELSA、美国HRS、欧洲SHARE和中国CHARLS,样本总量超过2.3万人,随访时间长(中位10.8年),具有很强的代表性和推广性。②各队列均采用标准化量表(CES-D、EURO-D)多次评估抑郁症状,并通过认知测试或诊断算法评估痴呆结局,数据质量高。③中西方样本均涵盖,有助于检验研究结果在不同文化中的适用性。
发文新方式,能力MAX!








